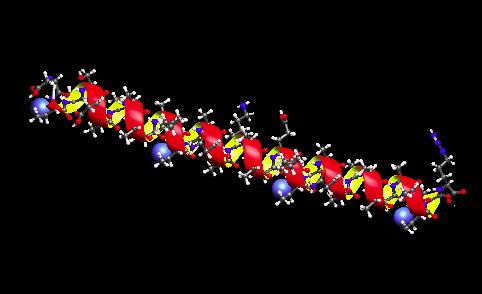
| 不凍蛋白質 (AFP) その2〉 * 図と文章:津田、本ホームページに掲載している図版の無断転載・コピーを固くお断り致します。 1.下の図は、連続したAla残基を多く含み一本鎖αらせん型構造の形成を特徴とするI型AFPのリボンモデルです。側鎖に水酸基を有するThr残基が 2, 13, 24, 35番目に配置し(青色のCPK)、またAsp(Asn)残基が5, 16, 27番目に配置していることから、これらの残基の極性原子が氷結晶面の酸素原子との間の水素結合を形成することが氷結晶結合に必須と考えられました。しかし、その後の研究により、Ala残基およびThr残基が有するメチル基が、疎水的相互作用によって氷結晶結合を起こすと考えられています。 |
 |
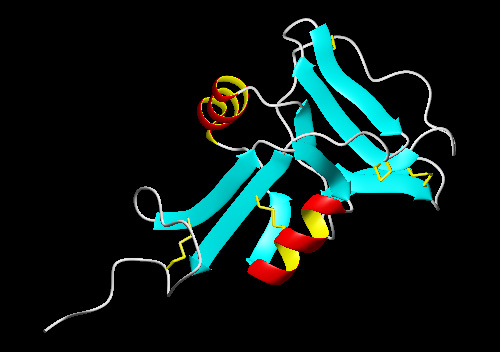
| 2.カルシウム依存型(C-type)レクチンの糖認識領域と高い相同性を有するII型AFPの予測構造モデルを下の図に示します(2005年現在、II型AFPのX線構造は解かれていません)。他の魚類AFPとは異なり、このAFPはSS結合によって構造が安定化していると考えられます。また、II型AFPには不凍活性の発現にカルシウムを必要とする種類とカルシウムを必要としない種類があると言われています。両者のもつ氷結晶結合部位や活性メカニズムには不明な点が多く、今後のより詳細な構造機能解析が待たれています。 |
 |
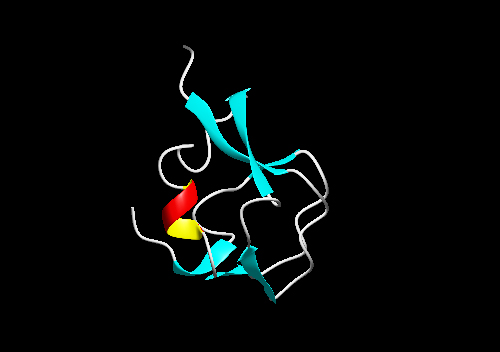
| 3.ヒト・シアル酸合成酵素のC末端側領域との相同性が指摘されているIII型AFPのリボンモデルを下の図に示します。III型AFPには陰イオン交換樹脂に結合するもの(QAEタイプ)と陽イオン交換樹脂に結合するタイプ(SPタイプ)に大きく分類されます。この構造は2層のコイル構造を特徴とするモチーフ(two-fold symmetry motifまたは pretzel foldと呼ばれる)で特徴づけられ、一方のコイル面上に氷結晶結合に関与する極性アミノ酸残基が配置していると考えられています。RD3は、2つのIII型AFPドメインが9残基の連結部位で結ばれたAFPです。 |
 |
| 4.108残基の一本鎖ポリペプチドからなるIV型AFPは、1997年に Loghorn Sculpinという名前のカジカの体液Sculpinという名前のカジカの体液から唯一の報告例のある不凍蛋白質です。IV型AFPはGluとGlnを多く含み、アポ・リポプロテインE3と高いアミノ酸配列相同性があることなどから下の図のような「ヘリックス束構造(αhelix-bundle)」の形成が予測されましたが真偽はいまだに不明です。この魚種が入手困難であること等の理由により、IV型AFPの研究は1998年以降世界的に殆ど進んでおらず、生化学的性質や不凍性能評価に関する新しい情報も全く得られないまま今日に至っています(下図は、モデル構造)。 |
 |